
Rút ngắn qui trình cấp phép và kỳ vọng tháng 9 có vaccine phòng covid-19 do Việt Nam sản xuất
(Pháp lý) - Đại dịch COVID-19 đã, đang và sẽ để lại những hậu quả rất to lớn với thế giới. Cùng với những tác động về dịch tễ và y tế, các ảnh hưởng chính trị và kinh tế xã hội toàn cầu sẽ rất sâu sắc. Trước tính chất cấp bách của đại dịch Covid-19, việc cấp phép sử dụng khẩn cấp vaccine đã được triển khai tại nhiều nước trên thế giới. Tại Việt Nam, ngày 21.8 vừa qua, Bộ Y tế cũng đã chính thức kí ban hành Thông tư 11 hoàn tất hành lang pháp lý cấp phép khẩn cấp vaccine COVID-19. Theo đó, thời gian cấp giấy đăng ký lưu hành vaccine Covid-19 trong trường hợp cấp bách được rút gọn chỉ còn 20 ngày so với quy định chung là 12 tháng. Với nỗ lực của Chính phủ VN và một số DN, người dân rất kỳ vọng tháng 9 này sẽ có vaccine phòng covid-19 do Việt Nam sản xuất.
Các nước rút ngắn quy trình cấp phép sử dụng vaccine
Mỹ là một trong những quốc gia đầu tiên trên thế giới đi theo quy trình cấp phép sử dụng khẩn cấp với 2 dòng vaccine Covid-19 là Moderna và Pfizer/BioNTech.
Đầu tháng 12-2020, sau khi có kết quả thử nghiệm hiệu quả giai đoạn 3 với 2 dòng vaccine trên, chính phủ dưới thời Tổng thống Donald Trump yêu cầu Cục Quản lý thực phẩm và dược phẩm Mỹ (FDA) nhanh chóng cấp phép sử dụng khẩn cấp.
Đến ngày 19-12, FDA hoàn tất cấp phép cho vaccine Moderna và Pfizer/BioNTech, mở đường cho hoạt động tiêm chủng diễn ra trên toàn nước Mỹ. Đây là một quy trình rút ngắn, chỉ diễn ra trong 1 tháng nên được gọi là cấp phép sử dụng khẩn cấp.
Thông thường, một dòng vaccine mất đến 10 tháng để được FDA cấp phép đầy đủ vì phải đối chiếu dữ liệu tiền lâm sàng và lâm sàng, quy trình và cơ sở sản xuất, báo cáo an toàn. Dự kiến, cuối quý 4 năm nay và đầu năm 2022, FDA mới chính thức cấp phép đầy đủ cho 2 dòng vaccine trên.
Tại châu Âu, Anh là nước đầu tiên cấp phép cho vaccine Covid-19 của tập đoàn Pfizer/BioNTech. Quyết định được Cơ quan Dược phẩm Anh đưa ra ngày 2-12-2020 sau khi xem xét kết quả thử nghiệm của dòng vaccine này. Đến ngày 21-12-2020, Cơ quan Quản lý dược phẩm châu Âu (EMA) cũng rút ngắn quy trình phê duyệt vaccine, chính thức cấp phép sử dụng khẩn cấp Pfizer/BioNTech.
Tại châu Á, Singapore là quốc gia đầu tiên cấp phép sử dụng vaccine Covid-19 của Pfizer/BioNTech sau khi được Cơ quan Khoa học y tế Singapore (HSA) phê duyệt ngày 14-12-2020. Quyết định trên được đưa ra sau khi HSA đánh giá các dữ liệu lâm sàng sẵn có và kết luận vaccine đã chứng minh hiệu quả phòng bệnh.
Theo quy định của Tổ chức Y tế thế giới (WHO) và các nước, vaccine trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó giai đoạn 3 có quy mô 20.000-50.000 người tham gia là quan trọng nhất.
Theo WHO, việc cấp giấy chứng nhận khẩn cấp nói trên không đồng nghĩa với việc hạ thấp tiêu chuẩn của vaccine Covid-19 vì đều dựa trên các dữ liệu thử nghiệm lâm sàng theo quy trình nghiêm ngặt ở 3 giai đoạn. Sau khi được cấp phép khẩn cấp tại một quốc gia, vaccine có thể được đăng ký cấp phép sử dụng khẩn cấp tại WHO.
Hiện các dòng vaccine Covid-19 được WHO cấp phép khẩn cấp đều qua quá trình đánh giá kỹ lưỡng của các chuyên gia y tế thế giới độc lập và trong nhóm của WHO. WHO đang giám sát hiệu quả những loại vaccine này trong thực tế, bao gồm ảnh hưởng của các biến chủng đáng lo ngại lên hiệu quả của vaccine.
Mục tiêu cuối cùng là Việt Nam sớm có vaccine tự mình sản xuất.
Kể từ khi đại dịch covid – 19 bùng phát, lãnh đạo Đảng, Nhà nước và Chính phủ Việt Nam đặc biệt quan tâm chăm lo bảo vệ tính mạng, sức khỏe nhân dân. Song song việc ngoại giao để có nhiều vaccine nhất tiêm cho người dân, Chủ tịch nước và Thủ tướng đã nhiều lần nhắc, đốc thúc ngành chức năng rút ngắn qui trình cấp phép, xem xét khẩn trương sớm đưa vaccine của Việt Nam vào sử dụng.
Ngày 29 tháng 7, tại buổi làm việc với đơn vị tiên phong đi đầu nghiên cứu sản xuất vaccine Nano Covax, Chủ tịch nước Nguyễn Xuân Phúc yêu cầu tháo gỡ thủ tục hành chính để sớm đưa vaccine này vào sử dụng, không để “toàn dân cần mà chúng ta cứ chậm”.

Theo Chủ tịch nước, lúc này, vaccine trở thành câu chuyện rất quan trọng trong chiến lược bảo vệ sức khỏe nhân dân. Trong đó, chiến lược vaccine của chúng ta là mua vaccine, đồng thời nghiên cứu vaccine trong nước để có thể tự chủ.
Ngày 12-8, tại trụ sở Chính phủ, Thủ tướng Phạm Minh Chính đã có cuộc làm việc với các nhà khoa học, các đơn vị, doanh nghiệp tham gia chuyển giao công nghệ, nghiên cứu, sản xuất vaccine phòng chống Covid-19 để tiếp tục tháo gỡ khó khăn, vướng mắc, thúc đẩy công tác này.
Thủ tướng Phạm Minh Chính nêu rõ: Chính phủ, Thủ tướng Chính phủ, Ban chỉ đạo quốc gia đã chỉ đạo quyết liệt, nhân dân hết sức quan tâm việc triển khai chiến lược vaccine. Để có vaccine tiêm cho người dân nhiều nhất, nhanh nhất có thể, chúng ta thực hiện đồng bộ “kiềng ba chân” gồm mua và nhập khẩu; chuyển giao công nghệ để sản xuất; nghiên cứu, sản xuất trong nước. Trong đó, việc nghiên cứu, chuyển giao công nghệ, sản xuất vaccine trong nước có vai trò rất quan trọng. Đây là chủ trương lớn của Đảng, Nhà nước, là công việc lớn của đất nước, được người dân rất trông đợi. Do đó, “phải bàn và làm bằng được” việc sản xuất vaccine trong nước

Tại cuộc họp, PGS-TS Lê Văn Truyền, Chủ tịch Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế khẳng định, sau khi Hội đồng đạo đức có ý kiến đối với thuốc, vaccine thực hiện thử nghiệm lâm sàng, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc sẽ làm việc khẩn trương nhất có thể, họp bất kỳ lúc nào cần để thực hiện các quy trình xem xét, đánh giá, trình Bộ Y tế xem xét cấp giấy đăng ký lưu hành có điều kiện theo đúng quy định.
Kết luận cuộc họp, Thủ tướng Phạm Minh Chính khẳng định lại quyết tâm cao phải nghiên cứu, chuyển giao, sản xuất được vaccine tại Việt Nam sớm nhất có thể. Các nhà khoa học, nhà quản lý, nhà sản xuất phải vào cuộc hết sức khẩn trương, rút gọn tối đa quy trình, thủ tục hành chính nhưng về mặt chuyên môn, khoa học phải chặt chẽ, đầy đủ hồ sơ, “dục tốc bất đạt”, do đây là lĩnh vực liên quan tới sức khỏe, tính mạng con người. Đặc biệt, về mặt chuyên môn, khoa học, vaccine dứt khoát phải do các cơ quan chuyên môn, khoa học có thẩm quyền đánh giá, bảo đảm 2 yêu cầu cốt lõi là tính an toàn và hiệu quả (hiệu quả điều trị của thuốc, hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch của vaccine).
Thủ tướng đề nghị Bộ Y tế, Bộ Khoa học và Công nghệ, các bộ có liên quan, các Hội đồng cùng “xắn tay áo” vào cuộc, hướng dẫn về quy trình, thủ tục để các đơn vị đang tiến hành nghiên cứu, chuyển giao công nghệ, thử nghiệm, sản xuất vaccine, thuốc và các trang thiết bị, vật tư y tế như kit xét nghiệm… đáp ứng ngay, không để vì thủ tục hành chính mà ách tắc công việc.
Thủ tướng yêu cầu kiện toàn tổ công tác đặc biệt của Bộ Y tế về vaccine phòng Covid-19, hoàn thiện quy chế hoạt động của Tổ nếu cần thiết và phải hoạt động thật hiệu quả, thực chất. Bộ trưởng Bộ Y tế ban hành thông tư về cấp giấy lưu hành thuốc và vaccine sản xuất trong nước theo tinh thần Nghị quyết 86 của Chính phủ.
Bộ Y tế, Bộ Tư pháp nghiên cứu, đề xuất cấp có thẩm quyền trình kỳ họp thứ hai Quốc hội khóa XV sửa đổi quy định về thử nghiệm lâm sàng và thẩm quyền của Bộ trưởng Bộ Y tế trong Luật Dược. Bộ Tài chính, Bộ Y tế phối hợp nghiên cứu, quyết định hoặc đề xuất các cấp có thẩm quyền về chính sách ưu đãi cao nhất cho nghiên cứu, chuyển giao công nghệ, thử nghiệm, sản xuất vaccine, thuốc và các trang thiết bị, vật tư y tế phục vụ phòng chống dịch. Bộ Tư pháp rà soát các thủ tục bảo đảm đúng quy trình, quy định, chặt chẽ nhưng gọn và nhanh.
Việt Nam hoàn tất hành lang pháp lý cấp phép khẩn cấp vaccine COVID-19
Ngày 21.8 vừa qua, Bộ Y tế của Việt Nam cũng đã chính thức kí ban hành Thông tư 11 hoàn tất hành lang pháp lý cấp phép khẩn cấp vaccine COVID-19. Giá trị lớn nhất là Thông tư 11 được thiết kế riêng cho việc cấp phép vaccine phòng COVID-19 trong trường hợp cấp bách. Theo đó, thời gian cấp giấy đăng ký lưu hành vaccine Covid-19 trong trường hợp cấp bách được rút gọn chỉ còn 20 ngày so với quy định chung là 12 tháng. Thủ tục gia hạn giấy đăng ký lưu hành, thủ tục thay đổi, bổ sung giấy đăng ký lưu hành rút còn 18 ngày và 14 ngày so với thông thường là 3 tháng.
Hàng loạt thời hạn gắn liền với các quy trình chuyên môn, cần sự vào cuộc của nhiều đơn vị của ngành y tế, liên quan đến việc nghiên cứu, đánh giá hồ sơ phục vụ cho việc cấp đăng ký lưu hành vaccine vì vậy phải rút ngắn theo…
BOX: Giá trị lớn nhất là Thông tư 11 được thiết kế riêng cho việc cấp phép vaccine phòng COVID-19 trong trường hợp cấp bách. Theo đó, thời gian cấp giấy đăng ký lưu hành vaccine Covid-19 trong trường hợp cấp bách được rút gọn chỉ còn 20 ngày so với quy định chung là 12 tháng.
Các thủ tục rút gọn này được thực hiện trên nền pháp lý là Nghị quyết 86 của Chính phủ. Việc này cho phép xem xét cấp đăng ký lưu hành có điều kiện khi vaccine thử nghiệm lâm sàng ở Việt Nam mới chỉ có báo cáo giữa giữa kỳ giai đoạn 3, thay vì theo quy chuẩn là phải hoàn tất cả giai đoạn thử nghiệm lâm sàng quan trọng, thường cần nhiều thời gian này.
Vì vậy, để kiểm soát rủi ro, Thông tư 11 đưa ra điều kiện kèm theo là sau khi được cấp phép, vaccine phải được tiếp tục theo dõi về tính an toàn, hiệu quả; kiểm soát cả về đối tượng, số lượng, phạm vi sử dụng. Đơn vị đăng ký cấp lưu hành phải phối hợp với đơn vị sản xuất vaccine, tiếp tục thực hiện nghiên cứu lâm sàng, cập nhật dữ liệu theo hướng dẫn của Bộ Y tế.
Điểm đáng chú ý, Thông tư 11 hướng dẫn đăng ký lưu hành vaccine phòng COVID-19 “trong trường hợp cấp bách” nhưng không giải thích thế nào là “trường hợp cấp bách” đến mức phải rút gọn các thủ tục, điều kiện để cấp phép vaccine – vốn đòi hỏi rất cao về các tiêu chuẩn thử nghiệm lâm sàng trên người.
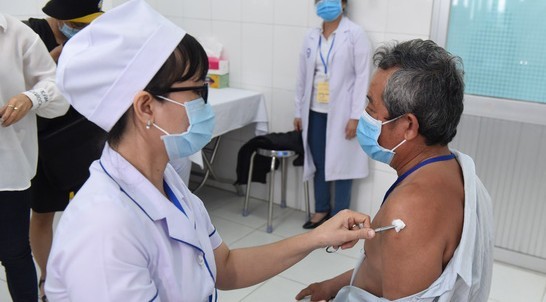
Tiêm vắc xin Nano Covax cho tình nguyện viên
Vậy nên, tùy thuộc vào thời điểm, tình hình dịch bệnh COVID-19, mức độ khan hiếm nguồn vaccine đạt chuẩn cũng như ngoại suy về hiệu quả của vaccine xin cấp phép mà Hội đồng Đạo đức trong nghiên cứu y sinh học cấp quốc gia, Hội đồng Tư vấn cấp Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc cùng Bộ Y tế sẽ phải đưa ra ý kiến, quyết định của mình.
Đây là cơ hội nhưng cũng là thách thức cho các vaccine nội, mà trước mắt chỉ mở ra đến ngày 31-12-2021, thời điểm hết hiệu lực của Thông tư 11, nếu không có quyết định mới.
Việc này cũng phải dựa trên cơ sở ý kiến tư vấn của Hội đồng đạo đức trong nghiên cứu y sinh học cấp quốc gia đối với vaccine thực hiện thử nghiệm lâm sàng tại Việt Nam và ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với từng vaccine cụ thể, có tham khảo hướng dẫn và khuyến cáo của Tổ chức Y tế thế giới.
Vaccine được cấp phép khẩn cấp trong trường hợp trên phải tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về đối tượng, số lượng, phạm vi sử dụng sau khi cấp giấy đăng ký lưu hành…
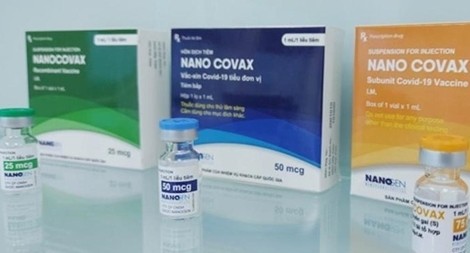
Về vaccine Nano Covax
Các doanh nghiệp trong nước hiện đang phát triển ba vaccine phòng COVID-19 đạt đến giai đoạn thử nghiệm lâm sàng trên người. Trong đó dẫn đầu là Nanocovax của Nanogen, những ngày này đang hoàn thiện và nộp hồ sơ đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3 để Hội đồng Đạo đức và Bộ Y tế xem xét.
Theo ông Hồ Nhân – CEO của Nanogen, vaccine đã được chứng minh là an toàn trên rất nhiều người đáp ứng sinh miễn dịch đối với các biến chủng. Công ty tập trung nghiên cứu để phù hợp với các chủng đột biến sau này và có hiệu lực bảo vệ thực sự. Đến tháng 8.2021, Nanogen đã ký biên bản ghi nhớ chuyển giao công nghệ cho 2 công ty ở Hàn Quốc và Ấn Độ.
Ông Hồ Nhân dẫn tình hình tại các nước Nga, Ấn Độ, Đài Loan (Trung Quốc) có 7 loại vaccine mới thử trên 400-500 người, đo tính sinh miễn dịch trên máu thấy có khả năng sinh kháng thể đạt trên 90% là cho sử dụng đại trà và tiếp tục theo dõi trên pha 3.
Ông Hồ Nhân cho biết, Công ty Nanogen cũng làm như vậy. Trong điều kiện bình thường, Nanogen không bao giờ đề nghị cấp giấy phép khẩn cấp, mà sẽ làm đủ pha 3, pha 4 mới đề nghị cấp giấy phép. Tuy nhiên, lúc này đang là tình hình dịch bệnh diễn biến phức tạp và vaccine Nano Covax đã đáp ứng được các tiêu chuẩn về khoa học, về an toàn. Vaccine Nano Covax đã thử nghiệm trên 14.000 người, chỉ có vài người sốt nhẹ, tỷ lệ rất thấp và không có ai tử vong. “Khả năng sản xuất, khả năng đảm bảo an toàn thì vaccine Nano Covax đều đáp ứng được. Chứng cứ khoa học công ty cũng có đủ với sự tham gia của các nhà khoa học trong và ngoài nước”, ông Hồ Nhân nói. Vì thế, công ty đã làm đủ hồ sơ pháp lý, đề nghị cấp phép khẩn cấp vaccine Nano Covax.
Được biết, sau hơn 8 tháng tiến hành 3 giai đoạn thử nghiệm lâm sàng vắc xin Nano Covax, với xấp xỉ 14.000 người đã được tiêm thử nghiệm, mới đây, ngày 23.8, Hội đồng đạo đức trong nghiên cứu y sinh quốc gia đã họp đánh giá giữa kỳ thử nghiệm giai đoạn 3. Theo thông tin ban đầu, phiên họp này nhằm đánh giá về tính an toàn, tính sinh miễn dịch ở giữa kỳ thử nghiệm lâm sàng giai đoạn 3a, với 1.000 người tình nguyện được tiêm ngừa. Giai đoạn 3b với 12.000 người được tiêm vẫn đang trong quá trình theo dõi, lấy mẫu và tiếp tục đánh giá.
Đây là phiên họp quan trọng trong tiến trình hoàn thiện hồ sơ, tiến tới xem xét có thể cấp phép khẩn cấp, có điều kiện cho Nano Covax hay không theo hướng dẫn mới nhất của Bộ Y tế.
Về thủ tục cấp giấy lưu hành vắc xin, Bộ Y tế hướng dẫn trong vòng 20 ngày làm việc kể từ khi nhận được đủ hồ sơ, Cục Quản lý dược sẽ cấp giấy phép đăng ký lưu hành vắc xin, trong trường hợp chưa cấp, cục sẽ phải thông báo rõ lý do.
Hướng dẫn đăng ký lưu hành vắc xin khẩn cấp đã có nhiều điểm mới so với thông thường, trong đó thông thường vắc xin mới sẽ phải hoàn tất 3 giai đoạn thử nghiệm lâm sàng mới được xem xét cấp phép, đồng thời phải chứng minh hiệu quả bảo vệ của vắc xin.
Với hướng dẫn này, Bộ Y tế cho phép cấp phép sau khi có đánh giá giữa kỳ giai đoạn 3, và những vắc xin như Nano Covax, Covivac, Arct-154 được cho là có cơ hội được xem xét cấp phép sớm hơn bình thường.
TS. Nguyễn Hữu Huân kiều bào Mỹ - Giám đốc khoa học Cty IGY Life Sciences đề xuất nên cấp phép khẩn cấp vaccine Nanocovax bởi 4 yếu tố: an toàn, hiệu quả, khả năng sản xuất và lợi ích.
Về hiệu quả, kết quả thử nghiệm của các vaccine Covid-19 đang được sử dụng trên thế giới đều cho thấy kết quả thử nghiệm lâm sàng giai đoạn 3 phù hợp với kết quả giai đoạn 1 và 2 (tác dụng bảo vệ liên quan trực tiếp đến kháng thể trung hòa). Nanocovax tạo kháng thể trung hòa tốt (kết quả thử nghiệm giai đoạn 2 đã cho thấy).
Đánh giá về lợi ích, theo TS. Nguyễn Hữu Huân, cho phép sử dụng khẩn cấp vaccine Nanocovax là cơ hội thành công cho Việt Nam trên lĩnh vực tự sản xuất được vaccine và tự khống chế được đại dịch.
TS. Nguyễn Hữu Huân cho rằng sử dụng đại trà vaccine Nanocovax tại thời điểm hiện nay rủi ro rất nhỏ (nếu có thì theo lý thuyết thấp hơn các vaccine hiện đang được lưu hành) nhưng lợi ích thì lớn.
Phúc Trang (T/h)
Link nội dung: //ids-ip.com/index.php/rut-ngan-qui-trinh-cap-phep-va-ky-vong-thang-9-co-vaccine-phong-covid-19-do-viet-nam-san-xuat-a253083.html